Areni
Areni ili aromatski ugljikovodici su ciklični ugljikovodici specifične strukture. Prsten je građen od šest atoma ugljika koji su međusobno povezani u pravilan šesterokut s naizmjeničnom jednostrukom i dvostrukom kovalentnom vezom. Takav se prsten naziva aromatskom jezgrom.
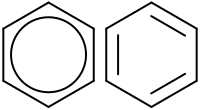
Delokalizacija uredi
Kod arena dolazi do delokalizacije elektrona, što se može vidjeti u primjeru C6H6 benzena. Struktura benzena bila je nepoznanica i tema brojnih diskusija. Smatralo se da benzen ima izmijenjujuće jednostruke i dvostruke veze između atoma ugljika. No tridesetih godina prošloga stoljeća, kada su nove tehnologije omoguće točna mjerenja duljina veza između ugljikovih atoma u benzenu, pokazalo se da je benzen planarna molekula i da svih šest veza između ugljikovih atoma imaju istu duljinu i to duljine od 1.39 Å, a ne izmjenjujuće jednostruke veze (duljine 1.54 Å) i dvostruke veze (duljine 1.33 Å).[1]
Objašnjenje takve opservacije je to da atomi ugljika u benzenu prolaze kroz sp2 hibridizaciju, formirajući tri σ veze i jednu π vezu. Zbog strukture benzena, svaki atom ugljika ima jednu "neiskorištenu" p-orbitalu s kojom formira π vezu s ostalim ugljicima u benzenu, odnosno svaki elektron iz p-orbitale svakoga ugljika biva podijeljen s elektronima (iz p-orbitala) ostalih atoma ugljika. Ovaj fenomen se još naziva i delokalizacija, zato što takvi elektroni nisu ograničeni na jedan atom, već ih dijele svih šest atoma ugljika. Riječ je o kvantnomehaničkom fenomenu koji omogućuje arenima da budu izrazito stabilne molekule.[2]
Homologni niz uredi
Opća formula homolognog niza arena je CnH2n-6.
| Redni broj | Ime | Molekulska formula | Sažeta strukturna formula |
|---|---|---|---|
| 1. | benzen | C6H6 | |
| 2. | toluen | C7H8 | |
| 3. | ksilen | C8H10 |
Svojstva uredi
Fizikalna uredi
Areni su tekućine ili čvrste tvari karakterističnog mirisa. Vrelište im raste s porastom relativne molekulske mase. Ne otapaju se u vodi, ali se dobro otapaju u organskim otapalima. Imaju niska vrelišta te hlape na sobnoj temperaturi, a njihove su pare zapaljive te u smjesi sa zrakom eksplozivne. Osim toga, pare su štetne za zdravlje te se smatra da su kancerogene.
Kemijska uredi
Areni nisu kemijski aktivni spojevi zbog velike stabilnosti aromatske jezgre. U kemijskim reakcijama ponašaju se slično alkanima. S halogenim elementima i jakim kiselinama reagiraju supstitucijom, a s elementarnim vodikom, uz platinu kao katalizator, reagiraju adicijom.
Nazivlje uredi
Nazivlje po IUPAC-u gotovo je identično nazivlju cikloalkena. Rednim se brojem označuju samo atomi ugljika u prstenu, i to tako da oni atomi na koje je vezan(a) skupina/atom koja/i je prva/i po abecedi dobije najmanji broj. Smjer brojenja određuje se po okolnim atomima ugljika - opet najmanji broj treba dobiti onaj atom ugljika na koji je vezan(a) skupina/atom koja/i je prva/i po abecedi. Atomi vodika se ne uzimaju u obzir. Nakon toga se izvodi naziv spoja: prvo se napiše broj atoma C na koji je vezan atom ili skupina atoma, a zatim naziv tog atoma ili skupine. Nazivi atoma ili skupina navode se abecednim redom, a između elemenata (brojevi te nazivi atoma ili skupina) pišu se povlake. Ako su na jedan atom C vezana dva ili više atoma (ili skupina), broj tog atoma se piše dva (ili više) puta, brojevi se odvajaju zarezom, a nazivu atoma ili skupine dodaje se prefiks - grčki broj atoma ili skupine. Nakon svega dodaje se sufiks '-benzen. Tako će naziv toluena po IUPAC-u biti 1-metilbenzen, a ksilena 1,2-dimetilbenzen. Spoj naziva 5-brom-3-metil-1propilbenzen izgleda ovako (atomi vodika na slobodnim atomima C u prstenu nisu naznačeni):
Br
|
C
// \
C C
| ||
H3C-C C-CH2CH2CH3
\\ /
C
Izomerija uredi
Izomeri pojedinog arena razlikuju se po položaju kemijskih skupina vezanih na prsten: kad su dvije skupine jedna do druge, to je orto-izomer (ili samo o-izomer), kad je između dviju skupina jedno prazno mjesto, radi se o meta-izomeru (m-izomer), a kad su dvije skupine na suprotim stranama prstena, govorimo o para-izomeru (p-izomer).
-
orto-ksilen
-
meta-ksilen
-
para-ksilen
Primjena uredi
Areni se koriste kao polazne tvari za dobivanje drugih organskih spojeva te za dobivanje plastičnih masa, boja, lijekova, insekticida i eksploziva. Tekući areni (ponajviše benzen) koriste se kao važna organska otapala.
| U G LJ I K O V O D I C I | |||||
| aciklički | ciklički | ||||
| ZASIĆENI | NEZASIĆENI | KARBOCIKLIČKI | HETEROCIKLIČKI | ||
| alkani | alkeni alkini |
zasićeni | nezasićeni | aromatski | |
| cikloalkani | cikloalkeni | areni | |||