Fenol
Fenol ili karbolna kiselina organski je spoj kemijske formule C6H5OH. To je bijela kristalna tvar. Molekule se sastoje od fenila (-C6H5) vezanog na hidroksilnu (-OH) skupinu. Proizvodi se u velikim količinama (oko 7 milijardi kg godišnje) kao prekursor (prethodnik) za mnoge materijale.[1] Ima samo blago kiselkasti karakter, ali zahtijeva pažljivo rukovanje zbog sklonosti da opeče kožu.
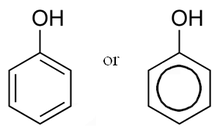
Riječ „fenol” također se koristi kao naziv za spojeve, koji sadrže šesteročlani aromatski prsten, vezan izravno na hidroksilnu skupinu (-OH). Fenoli su klasa organskih spojeva od kojih je fenol najjednostavniji član. Fenol je visoko topiv u vodi, s oko 8,3 g otopljeno u 100 mL (0,88 M). Natrijeva sol fenola - natrijev fenoksid, daleko je topljivija u vodi.
Fenol je blago kiseo. Njegova molekula ima slabu tendenciju gubitka H+ iona iz hidroksilne skupine, čineći fenolatni anion C6H5O− (ili fenoksid) koji je visoko topiv u vodi. U usporedbi s alifatskim alkoholima, fenol je oko milijun puta kiseliji, iako se još uvijek ne smatra slabom kiselinom. S NaOH otopljenim u vodi potpuno reagira i gubi H+, dok većina alkohola reagira samo djelomično. Fenoli su manje kiseli od karboksilnih kiselina, a još manje od ugljične kiseline.
Jedno od objašnjenja za povećanu kiselost u odnosu na alkohole je stabilizacija rezonancije fenoksidnog aniona aromatskim prstenom. Na taj se način negativni naboj kisika dijeli s orto i para atomima ugljika.[2] Drugo moguće objašnjenje za povećanu kiselost orbitalno je preklapanje između parova bez kisika i aromatskog sustava. Treće objašnjenje je indukcija iz sp2 hibridiziranih ugljika. Relativno jače induktivno povlačenje gustoće elektrona od strane sp2 sustava u usporedbi sa sp3 sustavom omogućuje veću stabilizaciju oksianiona.
Pri donošenju zaključaka treba uzeti u obzir pKa enol acetona, koji iznosi 19,0, u usporedbi s fenolnim pKa od 10,0. Sličnost kiselosti fenola i enol acetona ne javlja se u plinovitoj fazi zbog razlika u energijama otapanja deprotoniranog aceton enola i fenoksida. Nedavno je pokazano da je samo oko 1/3 povećane kiselosti fenola posljedica induktivnog učinka, a da je ostatak posljedica rezonancije.[3]
Galerija
uredi-
3D model fenola.
-
Fenol u epruveti.
Izvori
uredi- ↑ Manfred Weber, Markus Weber, Michael Kleine-Boymann "Phenol" in Ullmann's Encyclopedia of Industrial Chemistry 2004, Wiley-VCH. doi:10.1002/14356007.a19_299.pub2.
- ↑ McMurry John E. (1992). Fundamentals of Organic Chemistry (3rd ed.). Belmont: Wadsworth. ISBN 0-534-16218-5.
- ↑ Silva, Pedro J. (2009). „Inductive and Resonance Effects on the Acidities of Phenol, Enols, and Carbonyl α-Hydrogens.”. J. Org. Chem. 74 (2): 914—916. PMID 19053615. doi:10.1021/jo8018736.