Bohrov radijus
Bohrov radijus ili Bohrov polumjer je mjerna jedinica je za mjerenje duljine, a upotrebljava se prije svega u atomskoj fizici. Bohrov radijus jednak je 5,291 772 108 (18)·10-11 m. Osnovno Bohrovo objašnjenje polumjera kao udaljenost, na kojoj elektron kruži oko jezgre u okviru kvantne teorije je zastarjela. Bohrov radijus je tako potrebno razumjeti kao prosječnu udaljenost elektrona od jezgre u osnovnom stanju vodikovog atoma odnosno kao veličinu pripadajućeg vjerojatnosnog redoslijeda položaja elektrona.


Bohrova teorija vodikova spektra
urediN. Bohr je kvantizirao impuls vrtnje da bi objasnio iskustveno proučeni vodikov spektar. U svojim prvim pokušajima učinio je Bohr najjednostavniju pretpostavku da se elektron oko atomske jezgre kreće u kružnicama. Po Newtonovu zakonu gibanja, umnožak mase i ubrzanja (akceleracije) jednak je sili. Ubrzanje je kod kružnog gibanja jednako v2/r. Uzet ćemo općenito, da je električni naboj jezgre jednak Z∙e, pa je prema tome sila na elektron jednaka Z∙e^2/r2. Jednadžba gibanja, prema tome, glasi:
Odatle vidimo, da je kinetička energija jednaka:
Prema kvantnoj teoriji moguće su samo takve staze kod kojih je impuls vrtnje jednak:
Kvadrirajući ovu jednadžbu, dobivamo
Kako smo vidjeli, iz Newtonova zakona gibanja za m∙v2 veličina Z∙e2/r. Uvrstivši to u gornju jednadžbu dobivamo:
Iz kvantnog uvjeta za impuls vrtnje slijedi, dakle, da se elektron može kretati samo u kružnicama s polumjerom:
Kod vodika je Z jednako 1. Kvantni uvjet vodi, dakle, do rezultata da se elektron može kretati samo u određenim kružnicama. Polumjeri tih kružnica rastu kao kvadrati cijelih brojeva:
Postoji najmanja staza elektrona. Polumjer te prve Bohrove kružnice jednak je:
Uvrstimo li poznate vrijednosti za Planckovu konstantu h, masu i naboj elektrona, dobivamo da je polumjer elektronske staze jednak 0,052 nm. Ova veličina potpuno se slaže s promjerima atoma, koji su dobiveni u kinetičkoj teoriji materije. Time smo našli prvo teoretsko objašnjenje za iskustvene veličine atoma. To je izvanredno značajan teoretski rezultat.
Ukupna energija elektrona jednaka je zbroju kinetičke i potencijalne energije:
Prema gornjoj jednadžbi to je jednako:
Uvrstimo li ovamo polumjer prema gornjoj jednadžbi dobivamo za energiju izraz:
Energije diskretnih staza elektrona odnose se kao brojevi 1/n2. Vodikov atom može poprimiti samo točno određeni niz energija. Najnižu energiju dobivamo kad stavimo n = 1. Najmanja Bohrova kružnica predstavlja, dakle, stabilno stanje atoma. Ova energija stabilnog stanja jednaka je:
Toliko veliki (pozitivni) rad moramo izvršiti da vodikovu atomu otrgnemo njegov jedini elektron. Rastavljeni proton i elektron imaju, prema prijašnjem objašnjenju, međusobnu energiju nula. No radnja koja je potrebna da se elektron otrgne može se iskustveno izmjeriti. Ta energija ionizacije vodika jednaka je 2,15∙10-4 J. Uvrstimo li u teoretski izraz poznate vrijednosti za m, e i h, nalazimo potpuno podudaranje s iskustvom.
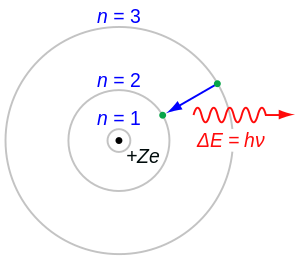
Vodikov atom je u stabilnom stanju kad se elektron vrti u najmanjoj kružnici. Vanjskim utjecajima možemo elektron prebaciti u neko više stacionarno stanje. Dok se elektron kreće u kojoj diskretnoj kružnici, on ne zrači svjetlost. Po Bohru, elektron zrači samo tada kad "skače" iz veće kružnice u manju. U samim stacionarnim stanjima, predočenim u diskretnim kružnicama, ne vrši se emisija ni apsorpcija, nego atom emitira ili apsorbira svjetlost samo onda kad prelazi iz jednog stacionarnog stanja u drugo. Frekvencija emitirane spektralne linije jednaka je, po drugom Bohrovu postulatu:
m, u nazivniku, je kvantni broj početnog stanja, a n konačnog. Za frekvenciju dobivamo odatle jednadžbu:
Kod vodika je Z = 1. Bohrova teorija vodikova spektra vodi, dakle, na iskustveno potvrđenu Balmerovu jednadžbu. Uvrstimo li brojčane vrijednosti m = 9,1∙10-28, e = 4,8∙10-10 i c = 2,9978∙1010, dobivamo za R vrijednost 109 737, 3, što se dobro slaže s iskustvenom Rydbergovom konstantom RH = 109 677, 581. Malo odstupanje potječe odatle, što se u vodikovu atomu i atomska jezgra kreće, pa naš račun nije sasvim točan.
Bohrova teorija daje vjernu sliku strogih zakona spektralne analize. U tome je njen najjači oslonac. Spektralni termi točno odgovaraju diskretnim energijama atomskih sistema. Sad nam je potpuno jasno kako nastaju pojedine spektralne serije vodika. Lymanova serija nastaje skokom elektrona iz viših energetskih nivoa u stabilno stanje s kvantnim brojem n = 1, Balmerova serija skokom elektrona u energetski nivo s kvantnim brojem n = 2, Paschenova serija u nivo s kvantnim brojem n = 3, i tako dalje. Čitav vodikov spektar može se pregledno prikazati slikom u kojoj diskretne Bohrove kružnice predočuju pojedina stacionarna stanja. Strelice između pojedinih kružnica označuju kvantne skokove.
Seriju (5) našao je Fowler u smjesi vodika i helija, a seriju (6) Pickering u jednoj svemirskoj maglici. Prije Bohrove teorije pogrešno su te dvije serije pripisivali vodiku. Uistinu, one potječu od helija. Ove spektralne linije javljaju se, kad pobudimo na emisiju ionizirani helij. U jednadžbama je skriven pravi karakter spektra ioniziranog helija. Ti se spektri mogu pisati i u obliku:
gdje je: m = 4, 5, 6 ….
gdje je: m = 5, 6, 7 ….
No to je upravo teorijski izraz za spektar ioniziranog helija.
Iz gornje jednadžbe se vidi, da se frekvencija nekih od tih linija podudaraju s frekvencijama Balmerove serije. Za m = 6, 8, 10, 12, … imamo:
Svaka druga linija te serije pada zajedno s jednom Balmerovom linijom. Spektar smjese vodika i ioniziranog helija točno je izmjeren. Mali pomak u linijama vodika i helija proizlazi iz gibanja njegovih jezgri. Iz spektralnih linija He+ i H mogu se vrlo točno izračunati spektralne konstante RHe i RH:
Ove iskustvene vrijednosti omogućuju nam, da točno odredimo omjer između mase elektrona i protona. Prema teoriji je:
Usporedba pokusa i teorije daje:[1]
Izvori
uredi- ↑ Ivan Supek: "Nova fizika", Školska knjiga Zagreb, 1966.
Vanjske poveznice
uredi- Pretvorba mjernih jedinica Arhivirana inačica izvorne stranice od 21. lipnja 2021. (Wayback Machine) konverter-jedinica.com