Elektrolit
Elektrolit je kemijski spoj koji je električki vodljiv ili to postaje u otopljenom ili rastaljenom stanju jer sadrži ili stvara pokretljive ione koji mogu prenositi električni naboj. Elektroliti koji su vodljivi u čvrstom stanju, kristalni su, ionski spojevi, u kojima se električni naboj prenosi ionima kroz šupljine u kristalnoj rešetki. Elektroliti koji postaju vodljivi tek u otopljenom ili rastaljenom stanju daju ione procesom elektrolitske disocijacije. Pritom se razlikuju takozvani pravi elektroliti, koji se i prije disocijacije sastoje od iona (praktično sve soli u obliku ionskih kristala), pa se rastavljaju na ione samo otapanjem, te potencijalni elektroliti, koji se prije disocijacije ne sastoje od iona, nego ih stvaraju tek reakcijom svojih molekula s molekulama otapala. Takvi su elektroliti na primjer sve kiseline i baze. Jaki su elektroliti oni koji su u otopini potpuno ili gotovo potpuno disocirani na ione (soli, jake kiseline i baze), a slabi oni koji su disocirani samo djelomično (slabe kiseline i baze).[1]


U biologiji i medicini, elektrolit je skupni naziv za anione i katione u živim bićima (vidi elektroliti (medicina)).
Pravi elektroliti
urediPravi elektroliti ili ionofori (grč. nosioci iona) jesu čvrste tvari kojima se kristalna rešetka sastoji od iona. Ako se takva rešetka razori grijanjem, to jest ako se pravi elektrolit rastali, dobije se tekućina koja se sastoji samo od iona, te je stoga električki vodljiva. Ako se kristalna rešetka pravog elektrolita razori time što se sile kojima su ioni među sobom vezani prevlada; u silama između dipolnih (ili kvadrupolnih) molekula polarnog otapala i iona u rešetki, to jest kad se pravi elektrolit otopi u polarnom otapalu, dobije se otopina u kojoj se osim molekula otapala nalazi gotovo isključivo među sobom nepovezani (solvatirani) ioni, raniji sastojci rešetke; takve su otopine, zbog toga, također vodljive i vodljivost im je praktički nezavisna od koncentracije otopine. Tipični su pravi elektroliti gotovo sve soli; disocijacija natrijevog klorida u vodi mogla bi se, na primjer, odrediti ovako:
- Na+Cl- + (n+ m) H2O → Na(H2O)n+ + Cl(H2O)m-
Potencijalni elektroliti
urediPotencijalni elektroliti ili ionogeni (grč. proizvoditelji iona) jesu kemijski spojevi koji se i u čvrstom i u tekućem (rastaljenom) stanju sastoje od neutralnih molekula sastavljenih od atoma među sobom vezanih u biti neionskim vezama, te stoga, kad su čisti, ni rastaljeni ne vode električnu struju, ali otopljeni u pogodnom otapalu reagiraju s njime uz postanak električki nabijenih čestica, iona. Tipični su potencijalni elektroliti organske kiseline; octena kiselina, na primjer, u vodenoj je otopini disocirana u ione zbog reakcije s vodom prema ovoj jednakosti:
- CH3COOH + H2O ⇄ CH3COO- + H2O+
Zbog toga što je ta reakcija reverzibilna, koncentracija iona u ravnotežnom stanju, a prema tome i vodljivost otopine, zavisi od koncentracije octene kiseline, to jest od njezine količine u odnosu prema količini vode; ravnotežno stanje, a prema tome također koncentracija iona i električna vodljivost uz danu koncentraciju elektrolita, načelno je različito za različite potencijalne elektrolite i za različita otapala. Tako je razrijeđena otopina octene kiseline u vodi razmjerno malo vodljiva (ravnoteža je pomaknuta ulijevo), a njezina je razrijeđena otopina u tekućem amonijaku jako vodljiva; razrijeđena otopina klorovodika u vodi (solna kiselina) ima razmjerno veliku električnu vodljivost, a njezina otopina u ledenoj octenoj kiselini, malu.[2]
Upotreba elektrolita
uredi- Elektrolitski vodiči se upotrebljavaju kod nekih elektronskih uređaja gdje se koristi interakcija metala i elektrolita;
- Kod baterija elektroliti u interakciji s nekim metalima služe za spremanje i dobivanje električne energije;
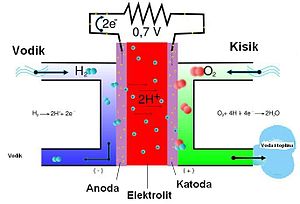
- Kod nekih gorivih ćelija (eng. fuel cell), kruti elektrolit (protonski vodič), služi za električno spajanje anode i katode, s time da odvaja vodik i kisik (plinovi za pogon nekih gorivih celija).
- Kod galvanizacije elektrolit nanosi metal na objekt koji treba biti zaštićen metalnim nanosom (cinčanje, niklanje, pozlata), a služi i kao vodič koji električki povezuje taj objekt u električni krug.
- Kod elektrolitskih kondenzatora kemijski učinak služi za stvaranje izuzetno tanke izolatorske prevlake, dok elektrolit služi kao kondenzatorska ploča.
- Kod hidrometara, vlažnost zraka se mjeri mjerenjem vodljivosti skoro suhog elektrolita. Mjenjanjem vlage u zraku, mjenja se i količina vode u elektrolitu, a s time i vodljivost elektrolita.