Vodikov peroksid
| Vodikov peroksid | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
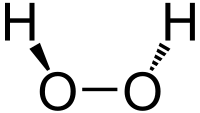 | ||||||||||||||
 Strukturna formula vodikova peroksida
| ||||||||||||||
| IUPAC nomenklatura | vodikov peroksid | |||||||||||||
| Ostala imena | Dioksidan Oksidanil | |||||||||||||
| Identifikacijski brojevi | ||||||||||||||
| CAS broj | 7722-84-1 ✓ | |||||||||||||
| UN broj | 2015 (>60% otop.) 2014 (20–60% otop.) 2984 (8–20% otop.) ? | |||||||||||||
| RTECS broj | MX0900000 X | |||||||||||||
| EC broj | 231-765-0 ✓ | |||||||||||||
| PubChem broj | 784 ✓ | |||||||||||||
| Osnovna svojstva | ||||||||||||||
| Molarna masa | 34,0147 g/mol | |||||||||||||
| Relativna molekulska masa | 34,0147 g/mol | |||||||||||||
| Izgled | Vrlo svjetlo plave boje; bezbojan u otopini, oštar miris | |||||||||||||
| Gustoća |
1.11 g/cm3 (20 °C, 30% (w/w) otop.)[1] | |||||||||||||
| Talište | 272,72 K -0,43 °C | |||||||||||||
| Vrelište | 423,35 K 150,2 °C | |||||||||||||
| Tlak para | ||||||||||||||
| Topljivost u vodi |
topljiv u bilo kojem omjeru | |||||||||||||
| Dipolni moment |
2,26 D | |||||||||||||
| Struktura | ||||||||||||||
| Sigurnosne upute | ||||||||||||||
| ||||||||||||||
| Međunarodni sustav mjernih jedinica primijenjen je gdje god je to bilo moguće. Ako nije drugačije naznačeno, upisane vrijednosti izmjerene su pri standardnim uvjetima. | ||||||||||||||
| Portal:Kemija | ||||||||||||||
Svojstva i osobine uredi
Bezbojna je i viskozna kapljevina, relativno stabilna na sobnoj temperaturi, ali se pri 80 °C egzotermno razlaže na vodu i kisik. Na sobnoj je temperaturi ta reakcija spora, a ubrzavaju ju nečistoće i svjetlost. Zbog toga se vodikov peroksid pohranjuje u tamnim bocama i uz dodatak inhibitora.
Djeluje i kao reducens, ali su oksidacijska svojstva jače izražena.
Dobivanje uredi
Nastaje hidrogeniranjem antrakinona i oksidacijom nastaloga antrakinola.
Upotreba uredi
Upotrebljava se za izbjeljivanje (ponajčešće kose), kao antiseptik, u kemijskoj industriji, a upotrebljavao se kao oksidans za raketno gorivo.
U prodaju dolazi u koncentracijama od 3,6,9,12, i 30% (takva koncentracija se naziva komercijalno i "Perhidrol").
Najčešće se koristi za dezinfekciju manjih rana i ogrebotina.
Izvori uredi
- Tehnički leksikon, Leksikografski zavod Miroslav Krleža; glavni urednik: Zvonimir Jakobović. Tiskanje dovršeno 21. prosinca 2007.g., Nacionalne i sveučilišne knjižnice u Zagrebu pod brojem 653717. ISBN 978-953-268-004-1, str. 969.
- ↑ Easton, M. F.; Mitchell, A. G.; Wynne-Jones, W. F. K. 1952. The behaviour of mixtures of hydrogen peroxide and water. Part 1.?Determination of the densities of mixtures of hydrogen peroxide and water. Transactions of the Faraday Society. 48: 796. doi:10.1039/TF9524800796
- ↑ CRC Handbook of Chemistry and Physics, CRC Press, 2006.
- ↑ NIOSH Pocket Guide to Chemical Hazards #0335. National Institute for Occupational Safety and Health (NIOSH)




