Kloroform
| Kloroform CHCl3 | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC nomenklatura | 1,1,1-triklormetan | ||||||||||||||||
| Ostala imena | triklormetan | ||||||||||||||||
| Identifikacijski brojevi | |||||||||||||||||
| CAS broj | 67-66-3 ✓ | ||||||||||||||||
| RTECS broj | FS9100000 ✓ | ||||||||||||||||
| EC broj | 200-663-8 ✓ | ||||||||||||||||
| PubChem broj | 6212 ✓ | ||||||||||||||||
| Osnovna svojstva | |||||||||||||||||
| Molarna masa | 117.914 g·mol−1 | ||||||||||||||||
| Relativna molekulska masa | 117.914 | ||||||||||||||||
| Izgled | bezbojna tekućina ugodnog mirisa | ||||||||||||||||
| Gustoća |
1.48 g·cm−3 | ||||||||||||||||
| Talište | 209 K -64 °C | ||||||||||||||||
| Vrelište | 334 K 61 °C | ||||||||||||||||
| Tlak para |
0.62 kPa (−40 °C) | ||||||||||||||||
| Topljivost u vodi |
10.62 g/L (0 °C) | ||||||||||||||||
| Dipolni moment |
1.15 D | ||||||||||||||||
| Struktura | |||||||||||||||||
| Oblik molekule | tetraedar | ||||||||||||||||
| Sigurnosne upute | |||||||||||||||||
| |||||||||||||||||
| Međunarodni sustav mjernih jedinica primijenjen je gdje god je to bilo moguće. Ako nije drugačije naznačeno, upisane vrijednosti izmjerene su pri standardnim uvjetima. | |||||||||||||||||
| Portal:Kemija | |||||||||||||||||
Kloroform (kloro- + -form; 1,1,1,-triklormetan, triklormetan, CHCl3) je bezbojna, hlapljiva tekućina, karakteristična i intenzivna mirisa i slatkasta okusa.
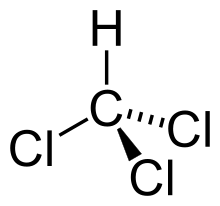
Osobine uredi
Vrije pri 61,2 °C, a gustoća mu je veća od vode: 1,49 g/cm³. Nezgodna je strana kloroforma je što stajanjem na zraku (nazočnost kisika) i pod utjecajem svjetla, raspada se na prilično otrovan fozgen, pa se danas nastoji, gdje je god to moguće, kloroform zamijeniti diklormetanom (metilen klorid, CH2Cl2). Ne miješa se s vodom, a za razliku od dietil-etera nije zapaljiv (neupaljiva je tekućina).
Dobivanje uredi
1. Prije se dobivao reakcijom etanola (ili acetona) s kalcijevim hipokloritom, no u ekonomskom je pogledu bolji acetaldehid kao početni materijal.
2. Dobivao se također redukcijom tetraklormetana sa željezom i vodom.
I metilenklorid i kloroform dobivaju se kloriranjem metilklorida, dobivenog od metilalkohola, te kloriranjem metana.
Uporaba uredi
Kloroform se rabi kao jako dobro svestrano otapalo (najčešće kao 65%-tni), za mnoge organske tvari i organske spojeve (osobito za ekstrahiranje penicilina).
Kloroform se je prije rabio u proizvodnji freona, ali ga je zamijenio diklormetan.
U medicini je služio kao opći anestetik, no kako štetno djeluje na srce (najčešće zastoj) i jetru, te izaziva druge neželjene nuspojave, njegova je uporaba u te svrhe potpuno napuštena te se danas u te svrhe ne primjenjuje.
Izvori uredi
- Hrvatska enciklopedija, Broj 5 (Hu-Km), str. 600. Za izdavača: Leksikografski zavod Miroslav Krleža, Zagreb 2003.g. ISBN 953-6036-35-5



